Sclérose en plaques
C'est une pathologie qui affecte le système nerveux central qui a une double composante: type auto-immun-inflammatoire et neurodégénératif. La SEP est une maladie démyélinisante chronique qui affecte principalement la substance blanche du SNC avec un processus inflammatoire qui détermine la formation de plaques sclérotiques. Les plaques de substance blanche peuvent apparaître n'importe où dans le SNC (cerveau et moelle). Les zones les plus fréquemment touchées sont les régions périventriculaires, le corps calleux, le tronc cérébral, le cervelet et les moelles postérieures ou antérolatérales de la moelle épinière (Calabrese et al, 2010). La composante neurodégénérative est secondaire à l'effet démyélinisant de l'attaque auto-immune-inflammatoire et implique des altérations des corps neuronaux et donc, dans ce cas, porté par la matière grise.
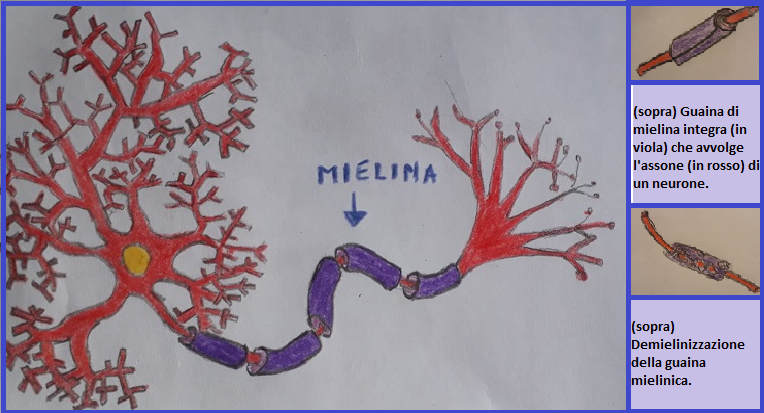
La physiopathologie de la SEP elle est liée au rôle que joue la myéline dans le SNC. La myéline est une gaine protectrice formée par les membranes cytoplasmiques de cellules spécialisées (oligodendrocytes) qui enveloppent les axones des neurones. Ce revêtement sert à isoler les axones du milieu environnant pour éviter les interférences dans la conduction de l'influx nerveux, qui est un signal de type électrique. Grâce à ce revêtement, l'influx nerveux se déplace très rapidement. La démyélinisation des axones donne lieu à une dispersion du signal électrique qui est ralentie à 20 fois par rapport à la norme jusqu'à un blocage total de la conduction. Il a été émis l'hypothèse que ce ralentissement pourrait être à l'origine de l'un des symptômes les plus récurrents de cette maladie, à savoir la "fatigue » (Kos et al, 2008).
Les plaques sclérotiques qui se forment à la suite du processus inflammatoire de la substance blanche, ils peuvent varier en taille et en forme. Les plus récents ont des contours plus flous et sont œdémateux et enflammés (PLAQUES AIGUS ACTIVES). Au fil du temps, ils évoluent vers une forme chronique (PLAQUE CHRONIQUE ACTIVE) dans lequel on observe que la destruction de la myéline s'est produite. Le processus se termine par une réaction cellulaire réparatrice (gliosi astrocitaria) qui forme une zone de cicatrice dans le but de réparer les lésions tissulaires. Dans cette dernière étape on parle de CHRONIC SILENT PLAQUE, consistance plus dure, par rapport aux plaques actives, et des contours bien définis.
L'étiopathogénie il est actuellement encore à l'étude. À l'heure actuelle, la recherche suggère l'existence d'une étiologie multifactorielle (une susceptibilité génétique et des facteurs environnementaux). L'une des hypothèses les plus accréditées est celle du mimétisme moléculaire: une affinité structurelle entre certains antigènes présents dans la myéline et les antigènes d'agents externes tels que les virus et les bactéries. Le immunoglobuline (Ig) produite par le système immunitaire pour se défendre contre certains agents externes affecterait ainsi également la myéline du système nerveux central.
Dans cette interprétation, la pathogenèse serait donc de type auto-immune. Lorsque les Ig se lient aux antigènes de la myéline, elles activent également les lymphocytes T et les macrophages qui détruisent la myéline. Ce processus est ensuite auto-alimenté par la production de cytokines pro-inflammatoires (TNF, LES 1, ..) qui augmentent l'inflammation locale en rappelant d'autres cellules inflammatoires.
Dans la phase initiale de cette pathologie, le patient subit une perte de fonction (le type dépend de la zone du SNC touchée) causée par l'œdème et le processus inflammatoire. Avec la régression de l'œdème et de l'inflammation, nous entrons dans la phase de rémission de la maladie.
Même dans les stades les plus avancés (phase chronique-progressive) il y a généralement une rémission du processus inflammatoire aigu, mais il reste une lésion tissulaire chronique due à une gliose réactive avec formation de zones cicatricielles avec de réelles lésions axonales irréversibles. Dans cette phase, le déficit neuromoteur se stabilise et il n'y a plus de régression des symptômes.
La progression de la SEP est définie comme « a poussés » avec des périodes de récupération et de remyélinisation ET IL EST JUSTE DANS CES MOMENTS QU'IL EST FONDAMENTAL D'EFFECTUER LA NEURORIABILITATION.
FORMES CLINIQUES:
- MONOSINTOMATIQUE (isolat clinique sindrom, SIC): se caractérise par un épisode symptomatique d'au moins 24 heures liées à une démyélinisation du SNC. L'incidence de cette forme est d'environ 20%.
- RÉCEPTEUR-ÉMETTEUR (Récidive-rémittente). Caractérisé par l'alternance de phases aiguës et de phases de rémission totale ou partielle des symptômes dans lesquelles la maladie ne progresse pas du tout. La durée des phases de rémission est variable. Dans 80% des cas au cours de la phase aiguë il y a l'apparition d'un symptôme qui atteint son apogée après environ deux semaines puis régresse dans les deux mois. Dans 50% des cas cette forme évolue vers la forme secondairement progressive (secondaire progressif) en moyenne dix ans après le début de la maladie. L'incidence est de 5%.
- DEUXIÈMEMENT PROGRESSIF (secondaire progressif). Elle se caractérise par une aggravation progressive des symptômes et donc une invalidité sans rémission. Il s'agit d'une évolution de la forme exacerbante-rémittente qui survient en moyenne dix ans après le début de la maladie..
- PRIMAIRE PROGRESSIF (primaire progressif). La progression des symptômes est lente mais s'établit dès le début de la maladie de manière progressive sans pause. Sous cette forme on ne peut pas parler de récupération neuromotrice mais de ralentissement des déficits. Cette forme a tendance à apparaître plus tard, même fréquence chez les hommes et les femmes. L'incidence de est de 15% environ.
- SYNDROME ISOLÉ RADIOLOGIQUEMENT (Syndrome radiologiquement isolé, SIF). Ce sont des cas dans lesquels on les trouve, au niveau du CNS, lésions typiques de la SEP en l'absence de symptômes.
SYMPTMES - TROUBLES PRIMAIRES
- Iposténie. Elle est due à l'altération des voies motrices centrales. La distribution dépend de l'emplacement des plaques, qui implique souvent des tableaux cliniques multifocaux. Le symptôme manifesté par le patient est généralement une sensation de fatigue, même au repos. Heureusement, la rééducation affecte fortement cette symptomatologie en réduisant sa gravité.
- Ipertonie. Elle consiste à augmenter le tonus musculaire de base (c'est-à-dire lorsque le muscle est au repos) et implique une plus grande résistance à la mobilisation passive en raison d'une accentuation des réflexes osseux- tendon (ou étirer les réflexes) qui sont activés en réponse à une tension musculaire. Elle peut également entraîner la présence de spasmes et de clones et provoquer des contractures. L'hypertonie réduit la mobilité, affecte négativement la marche (lorsque les membres inférieurs sont touchés) et sur la qualité du mouvement dans son ensemble, entraînant une diminution de la dextérité.
- Troubles de la marche. Ils peuvent résulter d'altérations du tonus musculaire dues à des lésions du système pyramidal ou extrapyramidal, mais aussi d'une altération de la proprioception ou de lésions du cervelet. Dans ces deux derniers cas, des problèmes d'équilibre surviennent qui impliquent un élargissement de la base d'appui et une instabilité posturale. Les principales démarches trouvées chez les patients atteints de SEP sont la faux et l'ataxie spastique et dérivent de la combinaison différente de lésions.
- Fatigue.
TROUBLES SECONDAIRES
- Contractures.
- Douleur dans le bas du dos. le 20% elle est du type primaire des névrites dues à une plaque au niveau de la racine ou dans les méninges de la moelle épinière alors que 80% est secondaire à des hernies ou des protubérances discales provoquées par une altération de la posture du patient.
- Troubles de la miction. La vessie est un sac avec des parois musculaires (muscle détrusor) qui sont soumis à un contrôle extrêmement raffiné et très complexe par le système nerveux central car il est divisé en plusieurs niveaux. Une lésion à n'importe quel point de ce système peut altérer le contrôle de la vessie entraînant différents symptômes pouvant aller de l'incontinence à la stagnation de la vessie avec le risque d'infections urogénitales.
- Troubles de la déglutition.
- Syndrome respiratoire restrictif. Il se produit lorsque le tonus altéré et la faiblesse affectent les muscles respiratoires.
- Troubles de la parole. Le type de ces troubles dépend de la localisation de la lésion.
- Déficience cognitive. Ce terme fait référence aux déficits affectant les fonctions corticales supérieures (attention, Mémoire, Langue, compétences en planification, résolution de problème, fonctions visuo-spatiales ...)
Calabrese M et al. Imaginez la distribution et la fréquence des lésions corticales chez les patients atteints de sclérose en plaques. Neurologie 2010
Kos, RÉ., Kerckhofs, E., clous, G., ré’hoogh, M.B., & Ilsbroukx, S. (2008). Origine de la fatigue dans la sclérose en plaques: revue de la littérature. Neuroréhabilitation et réparation neurale, 22(1), 91-100.